Wanneer men zout toevoegt aan smeltend ijs, dan zal er, doordat er wat zout oplost in het aanwezige water, een systeem ontstaan dat niet in evenwicht is. Om nu de evenwichtstoestand te kunnen bereiken, zal er tegelijkertijd ijs smelten en zout oplossen, processen waarvoor warmte nodig is. Die warmte wordt aan het mengsel onttrokken, dat daardoor afkoelt. De opname van warmte gaat door totdat of het zout is opgelost of het ijs gesmolten is. Als beide stoffen in grote hoeveelheden aanwezig zijn, dan daalt de temperatuur tot het eutectisch punt. Het systeem blijft dan op deze temperatuur totdat aan een van de eerder vermelde voorwaarden is voldaan. Daarna stijgt de temperatuur van het mengsel weer. Hetzelfde effect kan ook optreden bij andere mengsels die een eutectisch punt hebben. Bij een mengsel van keukenzout en ijs kan een temperatuur van -21 °C worden bereikt; voor een mengsel van calciumchloride en ijs kan een temperatuur van -55 °C bereikt worden..
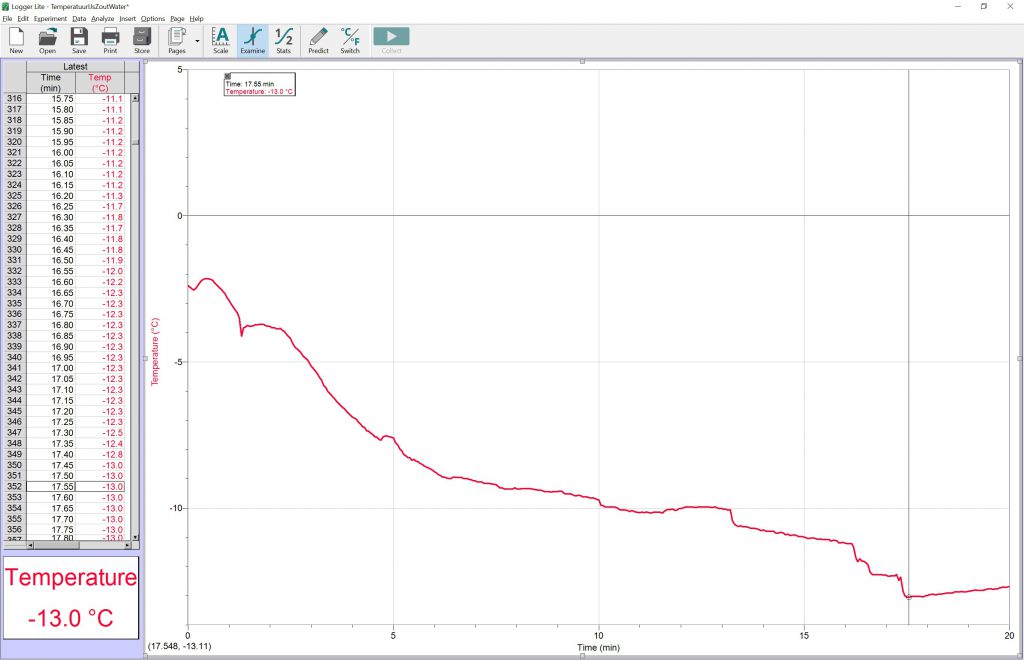
In onderstaande experimentje heb ik keukenzout aan een water-ijsmengsel toegevoegd en gedurende 20 minuten het temperatuurverloop gevolgd (Vernier Go!Link met temperatuursensor). Zoals men kan zien bereiken we een minimum van -13 °C.
(NB ik wilde even goed koud water maken voor een herkristallisatie)

Beste,
Ik denk dat u vergeet te vermelden dat uw experiment met het koudmakend mengsel “ijs+zout” niet werd uitgevoerd in open lucht maar in een afgesloten, goed geisoleerde calorimetrische bom.
Niet ?
Beste,
het experiment werd op een koffiewarmhoudplaatje (dat uit stond) met isolatiemantel uitgevoerd. Een goede isoolatie maar dat is alles.
M.vr.gr. Ruud