Kristallen gevormd door het indampen van een kaliumchromaat (K2CrO4) oplossing bekeken onder de polarisatiemicroscoop.
Microscoop:
Euromex BioBlue BB.4253 TriNoculair uitgerust met polarisatie filter
Objectief: 10x
Camera: Canon EOS 450D

Kleine experimenten die ik uitgevoerd heb.
Kristallen gevormd door het indampen van een kaliumchromaat (K2CrO4) oplossing bekeken onder de polarisatiemicroscoop.
Microscoop:
Euromex BioBlue BB.4253 TriNoculair uitgerust met polarisatie filter
Objectief: 10x
Camera: Canon EOS 450D

Kristallen gevormd door het indampen van een kaliumnitraat (KNO3) oplossing bekeken onder de polarisatiemicroscoop.
Microscoop:
Euromex BioBlue BB.4253 TriNoculair uitgerust met polarisatie filter
Objectief: 10x
Camera: Canon EOS 450D

De meeste kristallen die ik onder de microscoop bekijk maak ik door een oplossing in water te maken en die vervolgens in te dampen. Een andere methode die men kan gebruiken is een smelt. Neem een component met een laag smeltpunt (bv catechol dat smelt bij 105 °C) en plaats dat op een objectglaasje. Leg een dekglaasje op het poeder en pak het objectglaasje op met een tang. Hoe het glaasje op enige afstand van een spiritusvlam en laat voorzichtig het materiaal melten. Laat weer afkoelen en bekijk onder een polarisatiemicroscoop.
Microscoop:
Euromex BioBlue BB.4253 TriNoculair uitgerust met polarisatie filter
Objectief: 10x
Camera: Canon EOS 450D

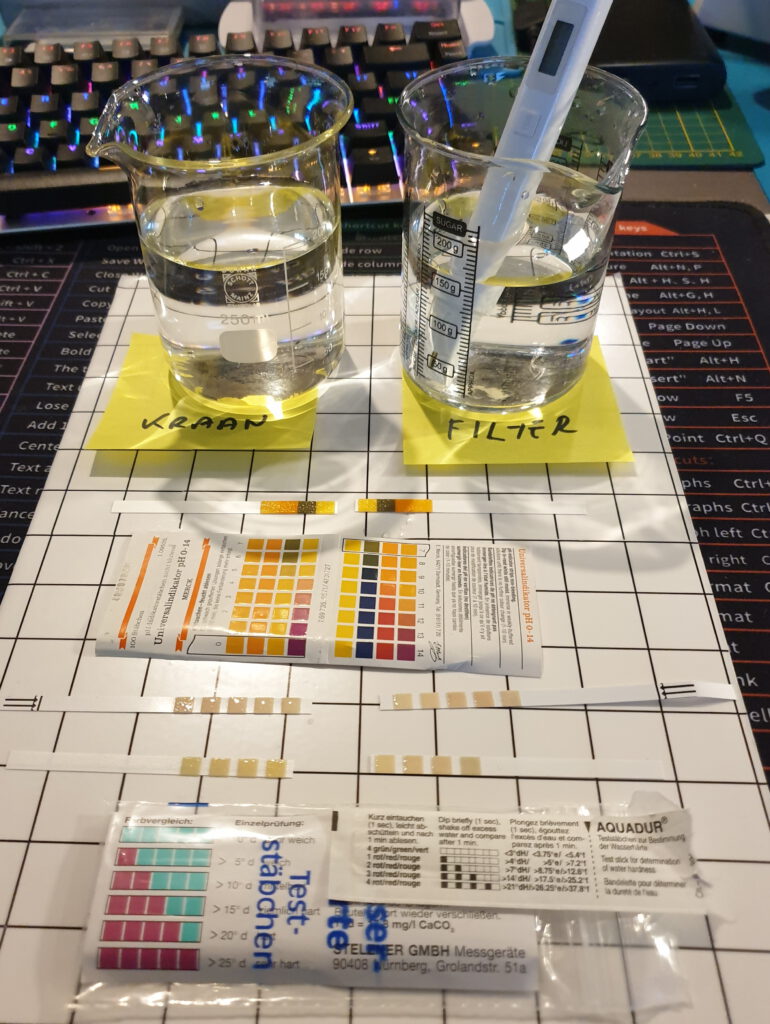
Ca. 1 maand geleden heb ik me laten overhalen om bij Bol.com een water filter voor de douchekop te bestellen en te installeren (Vitamo™ Premium Universele 15 Stage – Douchefilter & Extra Filter – Waterfilter Voor Douchekop). De voornaamste reden om dit filter te installeren was omdat het de hardheid omlaag zou brengen hetgeen dan beter zou zijn voor het haar. De installatie was gemakkelijk en mijn indruk was dat het goed ontworpen was. Het filter geeft geen merkbare extra drukval, de sterkte van de waterstraal is nog steeds in orde. De levensduur van het filter zou 6 maanden zijn. Dat maakte me al een beetje wantrouwend gezien de geadverteerde opbouw van het filter. Zoveel adsorbens zit er nou ook weer niet in en een aantal van deze materialen zullen niets veranderen aan de hardheid. Sommige laten je ook extra met de ogen fronsen bv “mineralized balls”, “alkaline balls”, “magnetic energy balls” en “medical stone”. Klinkt soms wetenschappelijk maar zegt uiteindelijk niets. KDF 55 is een koper/zink adsorbens dat gebruikt wordt voor het afvangen van chloride ionen en zware metalen.

Na een maand bedacht ik dat ik toch eens wilde controleren of het filter invloed heeft op de waterkwaliteit. Ik heb een paar middelen tot mijn beschikking waarmee ik snel een paar tests kan uitvoeren. Een Xiaomi TDS test pen waarmee men de concentratie “Total Dissolved Solids” kan meten (een maat voor de totale hoeveelheid opgeloste stoffen die ionen produceren), pH test strips en Hardheidsbepalings strips (Duitse hardheid (dH, Nederland = 10 mg (0.1783 mmol) CaO per liter). Laat de kraan even doorspoelen, spoel het monsterpotje enkele malen om en neem vervolgens een monster. De resultaten zijn samengevat in onderstaande tabel.
Datum: 5 december 2021
| KRAANWATER | FILTERWATER | |
| TDS (ppm) | 263 269 | 285 277 |
| pH | 7 | 7 |
| Hardheid (dH) | < 5 < 3 | < 5 < 3 |
Men kan zien dat het filter nagenoeg geen invloed uitoefent op de gemeten parameters, ook niet op de pH ondanks dat Vitamince C (ascorbinezuur) in het filter zou zitten. Als het er inderdaad inzit dan kan men gevoeglijk aannemen dat het binnen een maand volledig is opgelost, hetgeen nadelige consequenties kan hebben voor de strukturele integriteit van de filterbed (de vorming van preferential flow kanalen). De TDS waardes suggereren dat er zelfs op wat materiaal los komt uit het filter. Niet dat ik me daar zorgen over maak aangezien volgens de pen documentatie water met een TDS < 300 ppm nog steeds van uitstekende kwaliteit is. De pen werkt volgens het principe van geleidbaarheidsmeting, de geleidbaarheid van het water is dan een maat voor de hoeveelheid opgeloste materialen (mg/l = ppm). De documentatie van Xiaomi maakt echter niet duidelijk welke conversieformule gehanteerd wordt, daar is nl in de literatuur ook wel enige discussie over.
De met de test strips gemeten hardheid is erg laag. De hardheid van het water in Nederland licht typisch in de range 6-10 dH. Voor Hoofddorp is een waarde van ca. 8 dH gerapporteerd in het 2de kwartaal van 2021, hetgeen overeenkomt met zacht water (zie ook het artikel van de consumentenbond). Mijn test strips geven beduidend lagere waardes aan hetgeen mij na de eerste meting deed besluiten om de meting over te doen met andere strips, met hetzelfde resultaat (deze strips waren apart verpakt). Ik heb de strips echter al een paar jaar en ik weet niet wat de houdbaarheid is.
Desalniettemin kunnen we zelfs op basis van deze summiere resultaten concluderen dat dit filter geen significante invloed heeft op de kwaliteit van het water. Weggegooid geld dus.
Cobaltchloride kristal (CoCl2) gemaakt door indampen uit een waterige oplossing.
Microscoop: Euromex BioBlue BB.4253 TriNoculair uitgerust met polarisatie filter
Objectief: 10x
Camera: Canon EOS 450D

Een eenvoudig experiment dat laat zien dat een kompas naar het Noorden blijft wijzen.
Ammoniumoxalaat ((NH4)2(C2H4)) kristallen gemaakt door oxaalzuur te laten reageren met ammonia en de oplossing vervolgens in te dampen.
Microscoop: Euromex BioBlue BB.4253 TriNoculair uitgerust met polarisatie filter
Objectief: 4x
Camera: Canon EOS 450D
Foto: Gestacked met Picolay, gepolariseerd

Een olie-in-water emulsie maak je door eerst een beetje slaolie (enkele druppels) aan water toe te voegen en vervolgens enkele druppels zeep. Als je dan de oplossing goed schudt sla je luchtbellen in het systeem. Onder de microscoop kun je dan onderstaand plaatje waarnemen. De grote bellen zijn de luchtbellen, de kleine de oliedruppels. Ik heb ook enkele druppels groene kleurstof toegevoegd voor het contrast.

Plaats een druppel koperchloride (CuCl2) op een objectglaasje en plaats een dekglaasje eroverheen. Dep een teveel aan oplossing langs de randen weg met een tissue. Neem een klein stukje aluminium folie en leg dat tegen de rand van het dekglaasje aan. Men ziet de vorming van koper in een dendritische structuur volgens de volgende redoxreactie: 3Cu2+ + 2Al (s) –> 2Al3+ + 3Cu (s)
Microscoop: Dino-Lite AM4815ZT
Vergroting: ~40x
Video opname: 1 fps
Video afspelen: 15 fps
Lang geleden heb ik me aangemeld voor een Kickstart project genaamd “PoKit meter”. Typisch een apparaatje waar ik maar met moeite nee tegen kan zeggen en dat ondertussen in mijn bezit is. De PoKit zou (is) de kleinste multimeter, oscilloscoop en datalogger die men bedient met zijn mobiele telefoon of tablet (Android, Apple).
Piezo elektrische elementen hebben de eigenschap dat ze een oppervlaktelading produceren als ze gedeformeerd worden ten gevolge van een mechanische kracht. De lading is over een groot bereik evenredig met de kracht. Meestal voert men het element uit als een condensator, zodat volgens q=C.V het uitgangssignaal ook als spanning beschikbaar is. Het omgekeerde geldt ook, men kan piezo elektrische elementen vervormen door ze bloot te stellen aan een elektrische lading. Men kan bv. het element op deze manier als zoemer gebruiken.
Van die eigenschap kunnen we gebruik maken om een eenvoudig experiment met een piezo elektrisch element en de PoKit uit te voeren. Verbindt de Pokit met het piezo elektrische element. Start de PoKit app op en zet deze in Oscilloscoop modus. Tik vervolgens op het piezo element en observeer. Zoals men op onderstaande foto kan zien genereert men bij elk tikje een spanningspiek.
