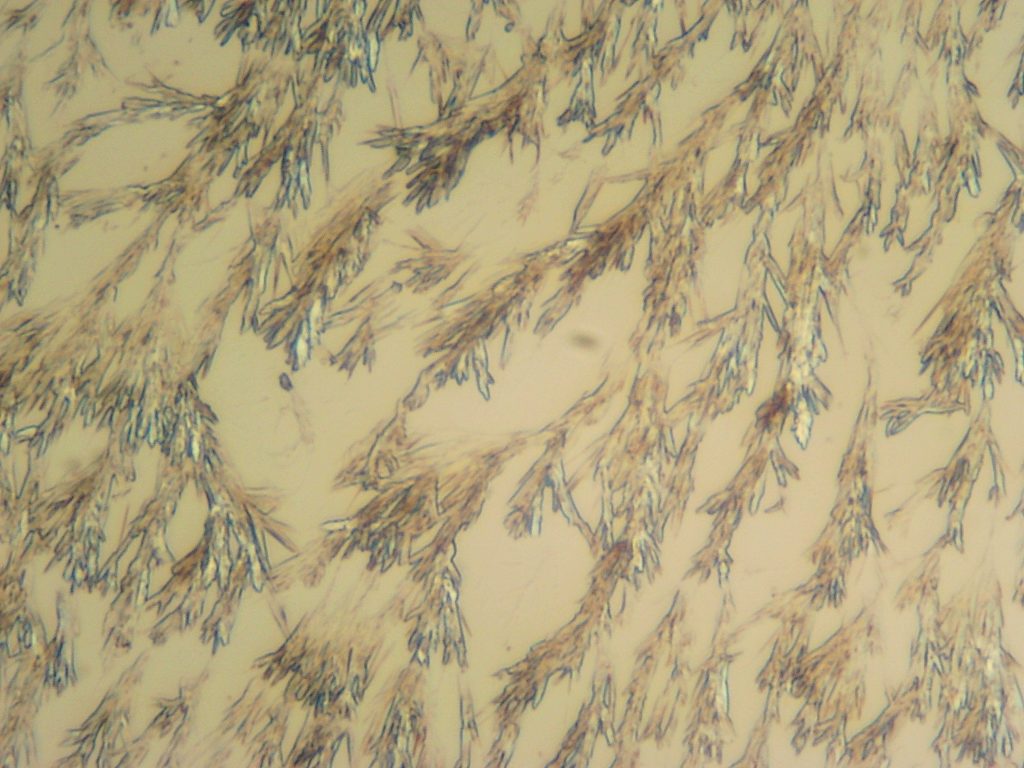
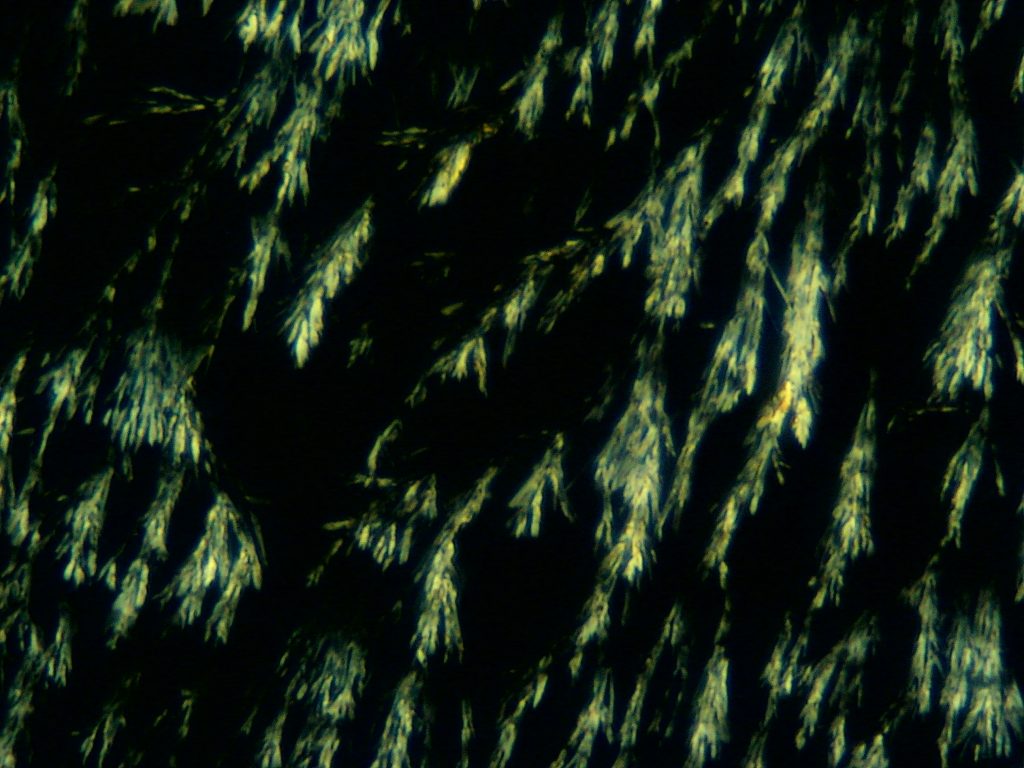
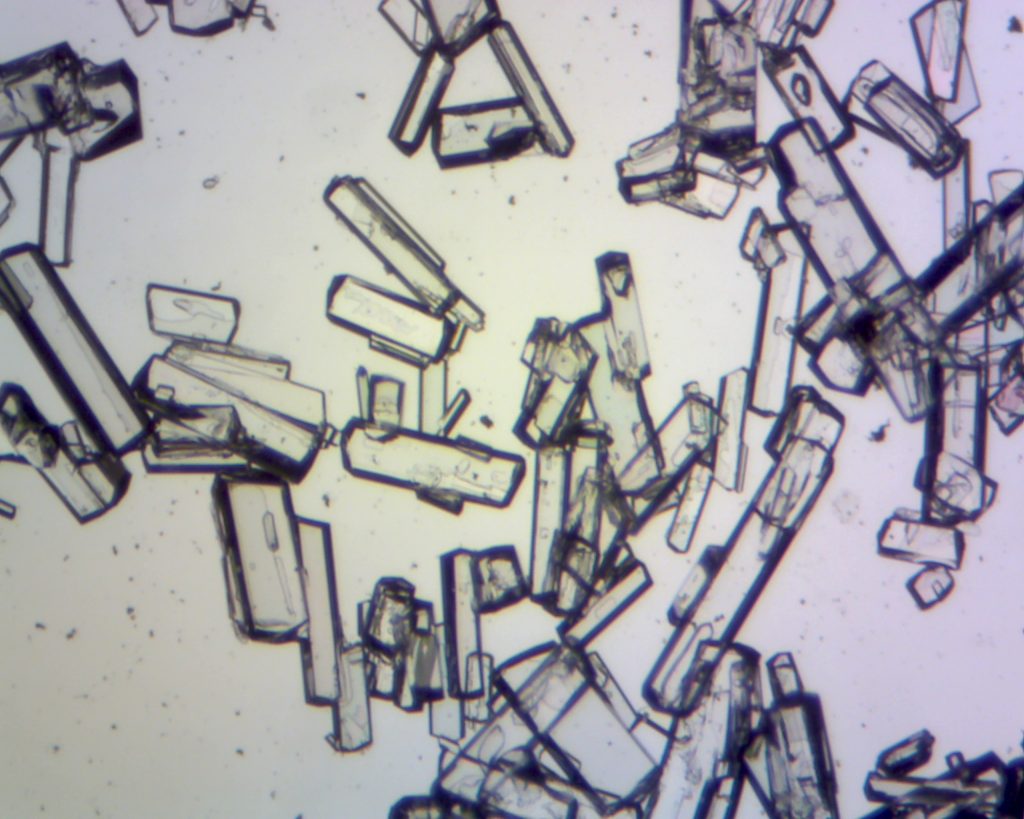
Gips is de verbinding van Calcium en sulfaat in de vorm van calciumsulfaat, CaSO4. De scheikundige naam van gips is Calcium-sulfaat.De aardkorst bestaat voor meer dan 3% uit calcium. Door de re-actieve eigenschappen komt het niet in ongebonden toestand voor. Mineralen waarin calcium voorkomt zijn o.a. gips, calciumcarbonaat en calciumfloride. Gips komt in verschillende kristalvormen voor. Er zijn mooi regelmatig gevormde kristallen en onregelmatige kristallen. De kristalvorm is van invloed op de hoeveelheid water die nodig is om een gietbare gipsbrij te kunnen maken. Vaak zijn in kristallen moleculen water ingebouwd. Dit heet kristalwater.
Gips kan bestaan in drie vormen:
- De Hemihydraat-vorm (1 molecuul kristalwater per 2 moleculen CaSO4)
Gipspoeder dat door toevoegen van water hard wordt.
- De Dihydraat-vorm (2 moleculen kristalwater op elk molecuul CaSO4)
Uitgeharde of ruwe gips.
- De Anhydraat-vorm (CaSO4 zonder kristalwater)
Een watervrije verbinding die niet meer reageert met water en vaak gebruikt wordt als vulstof voor de bouw, levensmiddellen industrie en de diervoeders industrie. Ook word deze gebruikt voor verbetering van landbouwgrond.
Wat gebeurt er als gips hard wordt:
Rehydratie van gips:
2CaSO4 x ½H2O + 3H2O –> 2 CaSO4 x 2H2O
CaSO4 + 2H2O –> CaSO4 x 2H2O
Als men hemihydraat-poeder mengt met water, dan vindt er een scheikundige reactie plaats. Daarbij neemt het hemihydraat water op en wordt dan uitgeharde gips. Dat uitgeharde gips vormt dan nieuwe kristallen. Deze nieuwe kristallen groeien langzaam uit tot grotere kristallen. Deze grotere kristallen haken in elkaar, en als de chemische reactie is afgelopen hebben we een harde massa gekregen.